新薬の開発過程と治験ついて解説

治験を行わなければ、新しい薬は生まれません。
治験と新薬について
皆さんは「新薬」と聞くと何を思い浮かべますか?
誰もが忘れられない記憶となった、2020年2月頃から世界的に大流行した新型コロナウイルス。新聞の片隅に小さな記事で取り上げられていた未知の病気が、その後ほんのわずかな期間で急速に蔓延し、人々を恐怖に陥れました。というのも流行当時において、この病気には特効薬もワクチンもありません。無症状~軽症~重症と、症状の度合いも人により様々ですが、ひとたび悪化が進むと進行が早く重篤な状態となり死亡するケースも多くみられたことから、世界的規模で治療薬の模索とワクチン開発が現在(2020年6月)もなお急ピッチで進められています。既存の治療薬がないことから、他の疾病の治療薬で有効となる薬がないか、世界各国の医療現場で、手探りで検証を繰り返しながら、厚生労働省は2020年5月7日、レムデシビル(製品名・ベクルリー)を新型コロナウイルス感染症に対する国内初の治療薬として承認しました。米国ではFDA(食品医薬品局)が5月1日に緊急的な使用を許可しており、日本でもこれを受けて特例承認を適用。同月4日の承認申請から3日でのスピード承認となりました。
このように、短期間で薬の承認が進むというのは本当に異例で、通常新薬の治験ならば開発から治験期間を経て、厚生労働省に承認され市場に出回るまでにはおよそ10年から15年の年月がかかると言われています。
今後、この新型コロナウイルスに対しても、様々な治療薬やワクチンが開発されていくかと思いますが、ここでは通常の新薬開発のプロセスと治験について、ご説明させていただきます。
新薬開発のプロセス
通常、ひとつのお薬が誕生するには、基礎研究から始まり販売に至るまでに、10年以上のとても長い歳月と膨大な開発費用がかかると言われています。
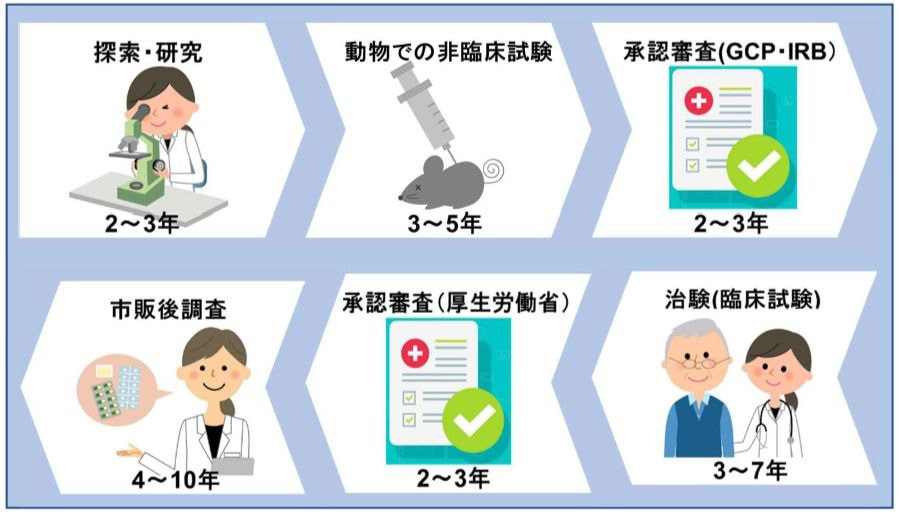
そして、この一連のプロセスの中で、薬の開発において欠かすことのできない重要な過程が治験(臨床試験)です。
治験とは
治験=新しい薬が国に認可され販売できるようにするための、人を対象とした臨床試験のこと。
国の認可を得るためには、有効性(既存の薬と比べて効果が高いか)と安全性(既存の薬と比べて副作用が少ないか)を確認しなければなりません。その確認をするために度重なる治験を実施し、臨床データを蓄積、検証する必要があるのです。最終的に、その収集した臨床データを国へ提出し、厚生労働省で承認が下りると実際に薬として販売が可能となります。
治験の流れ
ひとつのお薬の治験でも、段階を踏んで治験が進行しています。
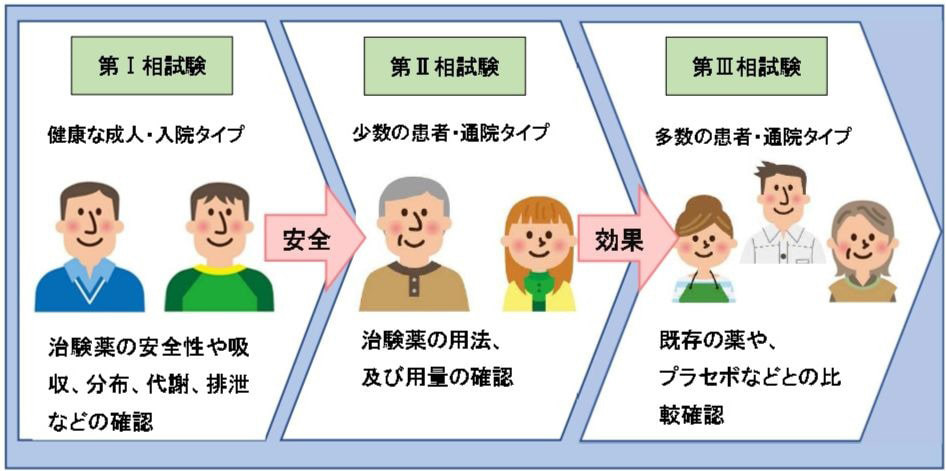
第Ⅰ相試験
健康な方を対象にした主に入院タイプの治験。
「くすり」の候補となる薬剤(以下治験薬という)をごく少量の投与から始め、治験薬の安全性や体内で吸収から排泄されるまでの代謝(薬物動態)を確認する試験です。
第Ⅱ相試験
第Ⅰ相試験で安全性が確認されると、次の段階の第Ⅱ相試験へと進みます。
比較的少数の患者さんを対象にした主に通院タイプの治験。
治験薬の用法及び用量のパターンをいくつか試し、治験薬の効果と副作用の両方を確認した上で、最適な使用法を模索、研究する。
第Ⅲ相試験
第Ⅱ相試験の研究結果をもとに、最適な使用法を確認した後、第Ⅲ相試験へと進みます。 多数の患者さんを対象にした主に通院タイプの治験。 治験薬を投与し、既存の薬に比べて効果が高いか、また副作用が少ないかなどの比較確認を行います。既存薬より何かしらの優れた点がなければ国の認可は得られません。 また、プラセボ(偽薬)との比較確認もこの段階で行います。
???プラセボってなぁに???
お薬を使わない患者さんでも病気が良くなることがあります。
例えばお医者様から診察を受けたという安心感や「治る」という思い込みによって症状が軽減したり、病気によっては時間の経過とともにひとりでに良くなっていく病気もあります。
こうした現象で症状が良くなっていった場合、本当に薬の効き目があったのか、はたまた思い込みの効果により改善したのか、病気の自然治癒によるものなのかを区別して評価する必要があります。そのために治験においてはプラセボ(偽薬)を用いる二重盲検試験が行われます。
プラセボ二重盲検比較試験
経口剤の場合、まず薬効を確かめたい治験薬と外観が区別できないように錠剤やカプセル剤を作ります(中身は薬の効果がなく、飲んでも安全なでんぷんや糖などを用いる)。プラセボ(偽薬)を摂取するグループと治験薬を摂取するグループとに分け、お医者様にも患者さんにも(二重)、どちらであるか分からないようにして被験者の患者さんに飲んでいただき、その効き目を比べます(盲検)。
結果として、何の薬効もないプラセボを飲んだ場合でも、症状がよくなる、あるいは副作用が出る方がいるというデータを踏まえて、治験薬の効き目や安全性を考えるのです。このプラセボと比較すると、効果のある治験薬では、やはりプラセボより高い有効率が示されるため、有効性の点で評価できるという結果となり、同様に副作用についてもプラセボと比べて許容できるか否かの評価をすることができます。
こういったプラセボ二重盲検比較試験は、治験薬の有効性や安全性を最終的に判断する上でも重要な試験となります。
治験を行う上でのルール、GCPについて
GCP(Good Clinical Practice)=医薬品の臨床試験の実施に関する基準
治験を実施するにあたり、遵守しなければならない厚生労働省で定めた省令。
日本においては、ヘルシンキ宣言(1964年世界医師会にて採択された被験者の人権保護に関する倫理規範)をもとに、まず平成元年に最初のGCPが定められましたが、あくまでも「通達」であり法的拘束力がありませんでした。その後治験のより一層の適正な実施や国際的調和を図る観点から、内容を改定し、平成9年3月に省令GCP(新GCP)として新たに定められ(平成9年3月厚生省令第28号)、平成10年4月から施行されています。名称もそれまでの「実施に関する基準」という記載から「実施の基準」というように、法的な効力を強調するものとなりました。
省令の趣旨
被験者の人権の保護、安全の保持及び福祉の向上を図り、治験の科学的な質及び成績の信頼性を確保するため、医薬品の臨床試験の実施に係る基準を定める。
具体的な内容
① 被験者の人権保護、安全性確保
治験担当医師は、被験者に対し文書により適切な説明を行い、文書により同意を得なければなりません。さらにCRC(治験コーディネーター)が時間をかけて患者に説明をし、治験を行うにあたり、ヘルシンキ宣言を遵守し倫理的観点において被験者の権利を守る義務があります。また、治験を実施したことで重大な副作用が見つかった場合は、製薬企業は国に報告する義務があり、必要に応じて治験計画の見直しなどを行います。
②治験の質の確保
製薬企業がプロトコル(治験実施計画書)を作成し、実施医療機関及び治験責任医師の選定、治験薬の管理、副作用情報等の収集、記録の保存その他の治験の依頼及び管理に係る業務の手順書を作成します。
治験を実施する前に、IRB(治験審査委員会)にて安全性・有効性・倫理性を調査します。IRBの構成員は、実施医療機関と利害関係を有しない者が加わっている必要があります。
③データの信頼性の確保
PMDA(独立行政法人 医薬品医療機器総合機構)による承認申請資料などの内容に関する信頼性調査を実施。
また製薬企業は、進行中の治験が「治験実施計画書」やGCPの規則を守って適正に行われているかを確認する意味で、治験のモニタリングや監査を実施することが義務づけられています。
④責任・役割分担の明確化
これまでの企業が行う治験に加えて、医療機関・医師が主体となって治験を行う、いわゆる医師主導の治験の制度化がなされ、医師も企業の場合と同等の責務を負うことになりました。
⑤記録の保存
治験実施計画書、症例報告書、臨床データ、被験者の同意取得文書、モニタリング・監査・その他の治験の依頼及び管理に係る業務の記録などを、所定の期間内適切に保存しなければなりません。
JCVNで募集している新薬の治験の一例(過去・現在含む)
第Ⅰ相試験
※健康成人対象試験の基本参加条件として、
・アレルギーやアトピーなどのない方
・治療中の病気やケガ、服薬などのない方
・刺青、タトゥーのない方(試験によりワンポイント可)
が対象者として基本の共通条件となります。
健康男性対象【入通院】試験☆5泊×2+通院5回
- ・実施場所:東京都内
- ・20~40歳の健康な日本人男性
- ・BMI19.0~24.4の方
- ・肺疾患、呼吸器系疾患の既往歴のない方
- ・その他条件有り
健康男性対象【入通院】試験☆5泊+通院7回
- ・実施場所:東京都内
- ・20~54歳の健康な日本人男性
- ・BMI18.5~24.5の方
- ・その他条件有り
健康男性対象【入通院】試験☆22泊+通院17回
- ・実施場所:東京都内
- ・20~44歳の健康な日本人男性
- ・BMI19.0~24.4の方
- ・その他条件有り
健康女性対象【入院】試験☆4泊
- ・実施場所:東京都内
- ・20~44歳の健康な日本人女性
- ・BMI17.6~24.9の方
- ・その他条件有り
健康女性対象【入通院】試験☆15泊+2泊+通院3回
- ・40~63歳の健康な日本人女性でかつ閉経後1年以上経過している方
- ・BMI19.0~24.5の方
- ・その他条件有り
中等症の乾癬にお悩みの方対象【入院】試験☆入院2泊1回
- ・実施場所:東京都内
- ・20~64歳の日本人男女
- ・1年以上前から尋常性乾癬を発症し診断を受けている方
- ・他の皮膚疾患がない方
- ・その他条件有り
2型糖尿病インスリン使用の方対象【通院+入院】試験☆通院12回+3泊1回
- ・実施場所:東京都内
- ・20~74歳の日本人男女
- ・BMIが18.5~40.0の方
- ・2型糖尿病の診断歴があり、インスリン(トレシーバかランタス)を使用されている方
- ・HbA1cの値が6.5~10.0%の方
- ・その他条件有り
第Ⅱ相試験・第Ⅲ相試験
脂質異常症の方対象【通院】試験☆約8回通院
- ・高コレステロール血症の指摘・診断を受けている方、
かつ下記のいずれかに該当する方 - ・無治療でLDL250以上
- ・リバロ4mg使用中
- ・アトルバスタチン(リピトール)20mg以上使用中且つLDL180以上
- ・ロスバスタチン(クレストール)10mg以上使用中且つLDL180以上
- ・リバロ2mg使用中且つLDL180以上
- ・1年3か月で8回程度の通院
- ・その他条件有り
COPD治療中の方対象【通院】治験☆約1年間で通院16回
- ・実施場所:東京都内
- ・50~80歳の日本人男女
- ・COPD(慢性閉塞性肺疾患)と診断された方
- ・お薬によるCOPDの治療を3カ月以上継続している方
- ・その他条件有り
変形性膝関節症の方対象【通院】通院約8回
- ・実施場所:東京都・埼玉県・熊本県
- ・40~85歳の日本人男女
- ・変形性膝関節症を診断された方
- ・その他条件有り
- ・5か月間に8回程度の通院
- ・その他条件有り
爪白癬にお悩みの方【通院】試験☆通院12回
- ・実施場所:東京都・千葉県・神奈川県・埼玉県
- ・20~69歳の日本人男女
- ・爪白癬の症状がある方
- ・約10か月間で12回の通院
- ・その他条件有り
ヘルペスの方対象【通院】治験
- ・実施場所:東京都・神奈川県・大阪府・福岡県
- ・18~79歳の日本人男女
- ・口唇ヘルペスor性器ヘルペスの再発を繰り返している方
- ・その他条件有り
アトピーの症状がある男女対象【入院】試験☆入院1泊1回
- ・実施場所:福岡県
- ・20~45歳の日本人男女
- ・アトピー性皮膚炎の診断がある方
- ・顔面、頸部にアトピー性皮膚炎の症状がある方
- ・その他条件有り
募集内容は随時更新されています。現在募集中治験の最新情報の閲覧やお申込みについてはJCVNホームページにてご確認下さい。またお電話やメールからでも、治験についてのお問合せ・お申込み等受け付けておりますのでお気軽にご連絡ください。



































