SMOとは
SMO(Site Management Organization:治験施設支援機関)は医療機関において煩雑な治験業務を支援する組織です。
平成10年4月、「医薬品の臨床試験の実施の基準に関する省令(=GCP*下記参照」が施行され、治験が行われる医療機関での書類の整備・管理や、手続きが複雑煩雑化し、国内での治験実施は海外に比べ遥かに停滞傾向にあり、「治験の空洞化現象」が見られるようになりました。
このような問題を改善するべく、治験の効率化を図るために医療機関の外部支援機関としてSMOが誕生し、平成15年7月の改正GCP省令において、SMO業務が法令上、正式に認められました。
治験に関わる主な機関
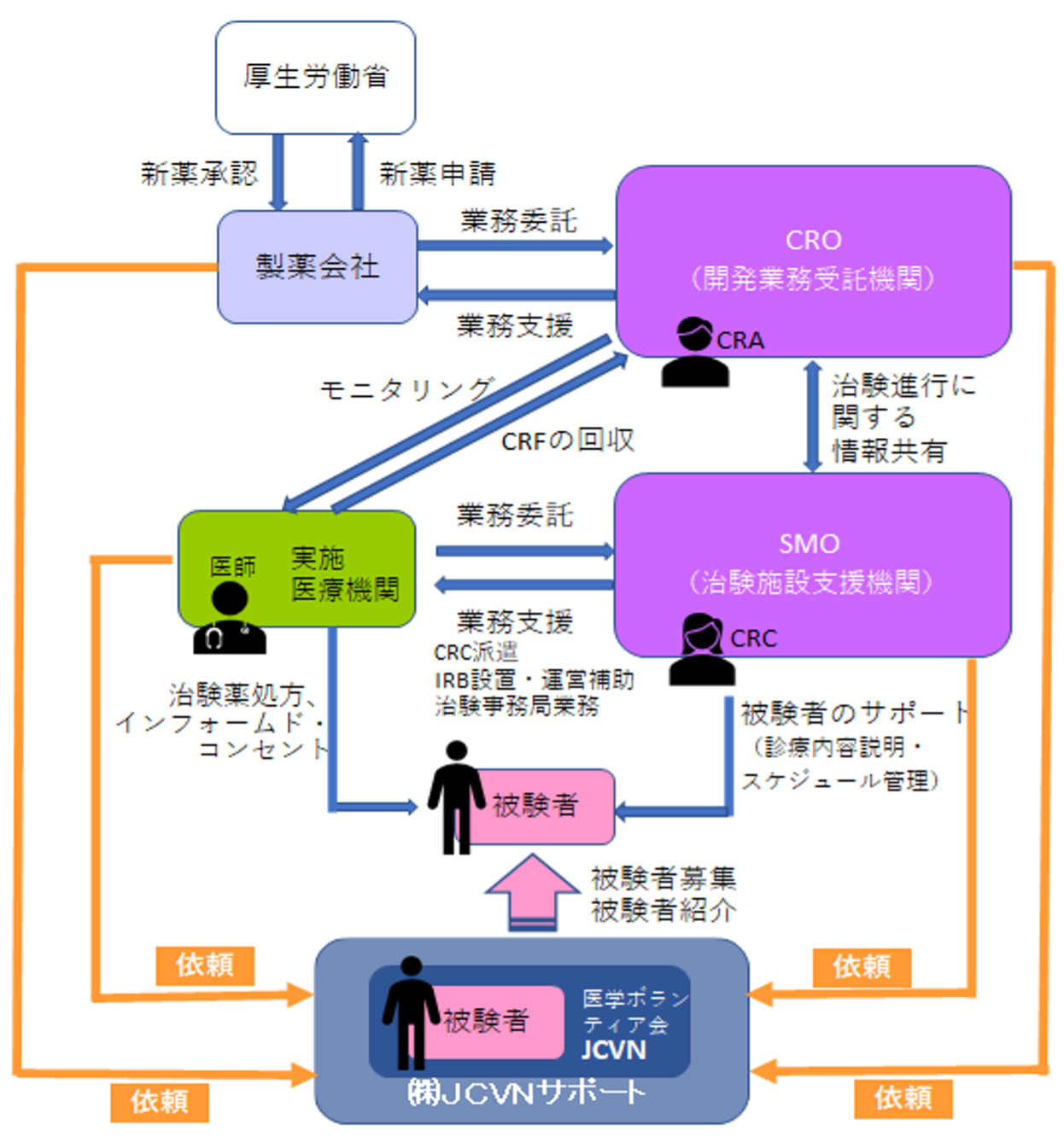
- ①製薬メーカーは新薬開発内容を厚生労働省に申請します。
- ②製薬メーカーは厚生労働省から承認を得ます。
- ③製薬メーカーはSMOへ開発業務を委託します。
- ④SMOは治験実施医療機関の選定及び治験実施の可否を調査します。
- ⑤治験実施医療機関は調査内容をSMOへ回答します。
- ⑥SMOは製薬メーカーへ回答を報告します。
- ⑦選定した医療機関での治験実施が可能であれば、製薬メーカーと契約を締結します。
- ⑧SMOは治験実施医療機関へCRCを派遣し、治験業務を支援します。
費用や契約について
治験において、CROは製薬会社を業務支援し、SMOは医療機関を業務支援する役割を担っています。それぞれの機関内で委受託契約等が結ばれていますが、治験実施における重要な要素のひとつに被験者の確保という問題があります。
被験者不足という業界の課題を解消するべく、弊社は被験者募集に特化した事業を行っております。PRO (Patient Recruit Organization)という立場で、治験の円滑な進行を支援し、その実績から昨今では製薬会社・CRO・SMOという様々な立場の機関からご依頼を頂くようになりました。
弊社との委受託費用に関する契約形態は、ご依頼いただく内容に合わせて二者間契約・三者間契約など、担当窓口にてお打ち合わせの上進めさせて頂きます。
SMOとCROの違い
SMOの主な業務
SMOとは、Site Management Organizationの略で、治験施設支援機関といいます。
SMOは治験を実施する医療機関と契約を結ぶことで、治験に関わる業務の一部を受託し業務支援しています。
平成10年4月、「医薬品の臨床試験の実施の基準に関する省令(=GCP*下記参照」が施行され、治験が行われる医療機関での書類の整備・管理や、手続きが複雑煩雑化し、国内での治験実施は海外に比べ遥かに停滞傾向にあり、「治験の空洞化現象」が見られるようになりました。
このような問題を改善するべく、治験の効率化を図るために医療機関の外部支援機関としてSMOが誕生し、平成15年7月の改正GCP省令において、SMO業務が法令上、正式に認められました。
医療機関での治験開始までの補助
主に事務業務を支援し、書類作成補助及び書類作成を行います。書類の種類には、治験開始前の業務フロー・治験開始のための施設標準作業手順書、症例報告書、治験事務局やIRB(治験審査委員会)事務局の議事録、審査結果報告書、被験者の同意説明文書などがあります。
医療機関での治験実施の補助
院内に治験事務局を立ち上げ、治験に関わるあらゆる情報を集約、進行状況の管理、製薬会社との窓口といった運営管理を行います。
IRB(治験審査委員会)設立と運営の補助
IRBは中立的な立場で治験の倫理性・安全性、科学的妥当性を審査する組織であり、SMOはIRBの設立のサポートや、委員への会議招集、資料作成、議事録などの記録の作成を行います。
CRC(治験コーディネーター)の育成と医療機関への派遣
SMOから派遣された治験コーディネーター(CRC:Clinical Research Coordinator)は、治験業務の補助要員として担当医師によるインフォームド・コンセントの案内、診察や検査の立ち会い、被験者のスケジュール管理、服薬状況の確認や残薬回収などの業務を行っています。医師や看護師に代わって、治験に関わる煩雑な事務作業や治験関連業務全般をCRCが行うことで、治験の進行を円滑にするという重要な役割を担っています。
CROの主な業務
CROとは、Contract Research Organizationの略で、医薬品開発業務受託機関といいます。
製薬会社から業務を受託し、以下のような臨床開発全般の業務を支援する機関です。
モニタリング業務
GCP省令に基づき、被験者の人権や安全が保護されているか、治験実施計画書のチェック、治験データの信頼性が確保されているかなどを確認します。主にCRA(臨床開発モニター)が中心となって業務を行っています。
データマネジメント業務
回収された症例報告書(CRF)のデータベース化し、管理する業務を行っています。
統計解析業務
生物統計学の手法を用いてデータベース化された治験データを解析して有効性、安全性を検証し、評価する業務を行っています。
治験におけるCRCの役割
CRCはClinical Research Coordinatorの略で、「治験コーディネーター」と呼ばれています。CRCの具体的な業務内容としては、治験のスケジュール管理や書類・資料の作成、被験者管理(治験内容の説明・来院日のスケジュール管理・投与経過の記録管理・心身のケア・残薬の回収)等、治験業務全般となります。また、製薬会社や医師、CROなどの各機関との窓口となって各方面との連絡や調整作業なども業務の一つで、製薬会社の担当者やCRA・被験者との間に立ち、治験が円滑に進行するように段取りする重要な役割を担っています。
多くの場合、SMOに所属するCRCが、勤務先として治験実施施設である医療施設に派遣され業務にあたるケースが主ですが、院内CRCとして直接病院に所属しているケースもあります。業務内容として大きな違いはありませんが、院内CRCは規模が小さいことも多いため、一人で何でもこなさなければならない場合もあるようです。また、院内CRCは看護師や薬剤師などからの配置換えで配属される場合が多く、ほとんどの人が医療系の資格を持っています。しかしながら所属先に関わらず、CRCは医療行為に携わらないことが多く、特にSMOに所属するCRCは法律によって医療行為に携わることが禁止されています。